Введение.
Проведение лабораторного занятия по данной теме диктуется необходимостью обобщения сведений по классам неорганических веществ, углубление изученного в средней школе материала, а также усвоение современной номенклатуры неорганических веществ.
Неорганические вещества по своему химическому составу и свойствам можно разделить на несколько классов:
† Государственная ключевая лаборатория органических и неорганических композитов, Пекинский химико-технологический университет. Одним из основных источников, используемых в тропических почвах и кислотах, таких как наша, является известняк. Он также выделяется как недорогой вход.
В почве кислотность является показателем дефицита питательных веществ. Таким образом, наиболее распространенными причинами кислотности являются экспорт питательных веществ корнями растений, выщелачивание питательных веществ путем осаждения или орошения, эрозия почвы и использование подкисляющих удобрений.
Простые вещества.
Основания (гидроксида).
Простейшим классом неорганических соединений являются оксиды.
Оксиды - это соединение любого элемента с кислородом, в котором кислород непосредственно соединен с элементом:
(если связь осуществляется между атомами кислорода К-О-О-К то такие соединения называют пероксидами).
Корректировка кислотности дается применением Кислотных Коррективов, таких как минеральный известняк или сельскохозяйственный известняк, который состоит из карбонатов кальция и магния. Есть также Девы и Гидратированные набережные, состоящие из оксидов кальция и магния, более растворимых, чем карбонаты. Также могут использоваться альтернативные источники, такие как шлак извести или стальные шлаки, содержащие силикаты кальция и магния. Следует подчеркнуть, что штукатурное сельское хозяйство не корректирует кислотность, поскольку его использование не изменяет рН почвы.
Оксиды делятся на:
1. Основные - соединения кислорода с металлами. В основных оксидах металлы, как правило, проявляют валентность 1,2 реже 3. Основными они называются потому, что каждому из них соответствует основание (гидроксид):
|
Реакции металлов с кислотамиСуществует несколько различных типов известняка. Поскольку это минерал, извлеченный из горных пород, важно проанализировать его состав, который варьируется в зависимости от региона или характеристики шахты, из которой он извлекается. При выборе и приобретении известняка необходимо оценить минимальные гарантии, предлагаемые компанией-поставщиком, которые суммируются в процентах от кальция и магния, сила нейтрализации, гранулометрия и общая нейтральная сила нейтрализации. Тем не менее, важно отметить, что эти гарантии минимальны и не относятся точно к нагрузке, которая была доставлена на ваше имущество, а скорее к общему среднему уровню добываемой области. |
Оксид натрия |
|
Гидроксид натрия |
|
|
Оксид магния |
Именно потому, что он не является промышленным продуктом, состав сельскохозяйственного известняка может варьироваться от нагрузки до нагрузки, поскольку в природе его состав также не является однородным. Для наилучшего использования и применения кальция и магния в соответствии с рекомендацией, без риска применения субдоз или супердозов, наиболее эффективным и недорогим методом является направление образцов продукта в лабораторию и проведение анализа Корректировки кислоты. Единственной функцией известняка является корректировка кислотности почвыСуществует ряд мифов о применении известняка, которые необходимо уточнить. Корректировка кислотности почвы является одной из основных функций известняка, но не единственной! Важным, как повышение рН, является тот факт, что он обеспечивает кальций и магний, два макронутриентов, которые являются фундаментальными для физического структурирования почвы, для содействия микробной активности, для развития растений и для эффективности оплодотворения. Не говоря уже о том, что это самый дешевый способ обеспечить эти питательные вещества растениям. |
Гидроксид магния |
|
|
Оксид кальция |
|
Гидроксид кальция |
Если металл проявляет переменную валентность, то при названии оксида в скобках указывается валентность металла:
Для однолетних культур это может показаться интересным, но для многолетних культур не так много. Поскольку расчеты рекомендаций по известкованию учитывают этот показатель, все известняки способны корректировать почву в течение трех месяцев, что меняет требуемое количество.
Гипс не корректирует кислотность почвы, так как он состоит из сульфата кальция, который не имеет силы нейтрализации. Основная роль гипса состоит в том, чтобы скомпоновать токсичный алюминий, особенно тот, который расположен в глубинах, из-за которых трудно достигать известняк из-за его низкой растворимости. Гипс также может служить источником кальция и серы.
Главным свойством основных оксидов является их способность взаимодействовать с кислотами с образованием соли и воды.
Кислотные оксиды соединения кислорода с неметаллами, а также с некоторыми металлами, которые в кислотных оксидах проявляют высшую (или близкую к высшей) положительную степень окисления 1, 6, 7). Такие оксиды называются кислотными (или ангидридами кислот), потому что каждому из них соответствует кислота:
Существует несколько типов известняка. В зависимости от местоположения месторождения они могут содержать различные количества и пропорции кальция и магния, могут быть осадочного или метаморфического происхождения или морского происхождения, как в случае известняка. В дополнение к происхождению и химическому составу известняк может после шлифования и обработки породы представить себя несколькими гранулометрическими композициями. Все эти факторы оказывают большое влияние на реакцию известняка в почве.
|
Соответствующая оксиду кислота: |
|||
|
|
оксид серы (IV) сернистый ангидрид |
|
сернистая кислота |
|
Таким образом, выбор известняка никогда не должен производиться исключительно ценой или стоимостью груза, а скорее необходимостью почвы и культур для кальция, магния, рН, реактивности и остаточного эффекта. Известняк - это исправление с низкой растворимостью. Поэтому скорость реакции зависит от ее контакта с частицами почвы. Применение его на поверхность без его включения еще больше снижает его реактивность и затрудняет корректировку профиля. Не то, чтобы его эффект не достигал слоев ниже 10 см, но это происходит в медленном и малом масштабе, т.е. даже нейтрализует некоторую кислотность и способствует небольшому количеству кальция и магния, но по большей части это не фактически корректирует профиль. |
оксид серы (VI) сернистый ангидрид |
|
серная кислота |
|
|
оксид фосфора (V) фосфорный ангидрид |
|
фосфорная кислота |
Главным свойством кислотных оксидов (особенно оксидов неметаллов) является их способность взаимодействовать с основаниями с образованием соли и воды:
3.
Амфотерные -.оксиды металлов, которые
могут взаимодействовать как с кислотами,
так и со щелочами. Эти оксиды проявляют
свойства кислотных и основных оксидов.
Амфотерный характер носят оксиды
некоторый металлов, II, II1, IV
и некоторых других групп периодической
системы элементов:
 - оксид цинка;
- оксид цинка; -
оксид алюминия;
-
оксид алюминия; - оксид бериллия;
- оксид бериллия; - оксид хрома (III);
- оксид хрома (III);
 - оксид свинца (II) и др.
- оксид свинца (II) и др.
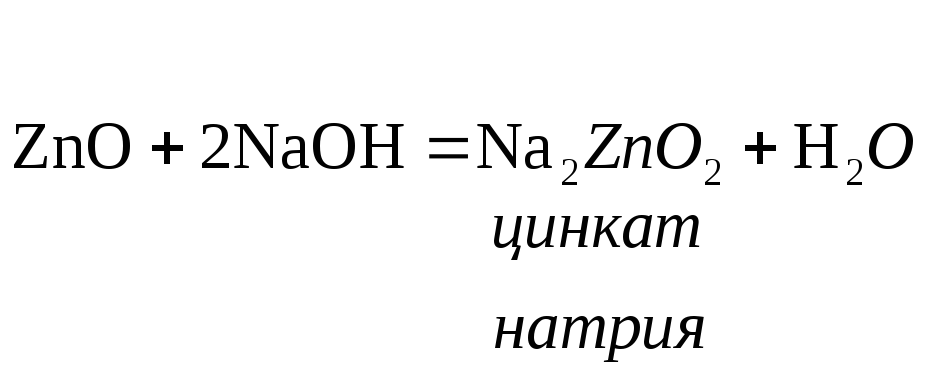
В водных растворах щелочей такие оксиды, как правило, дают комплексные соединения:

Все
перечисленные оксиды образуют соли;
поэтому они называются солеобразующими
оксидами, в отличии от несолеобразующих
оксидов, к которым относятся
 - оксид азота (I),
- оксид азота (I), - оксид азота (II),
- оксид азота (II),
 -
оксид углерода (II)
и некоторые другие.
-
оксид углерода (II)
и некоторые другие.
Гидроксиды.
Гидроксиды
- соединения оксида с водой, полученные
прямым или косвенным способом.
 - гидроксидам относятся основания,
амфотерные гидроксиды, кислоты.
- гидроксидам относятся основания,
амфотерные гидроксиды, кислоты.
Основания
- вещества, молекулы которых состоят из
атома металла и гидроксильных групп:
 ,
, ,
, ;
или веществ, которые образуют в водном
растворе из отрицательных ионов только
гидроксид ион:
;
или веществ, которые образуют в водном
растворе из отрицательных ионов только
гидроксид ион:
Основания,
растворенные в воде, называются щелочами
 - гидроксид натрия; КОН - гидроксид
калия;
- гидроксид натрия; КОН - гидроксид
калия; -
гидроксид бария;
-
гидроксид бария; -
гидроксид кальция. Металлы, образующие
в воде гидроксиды (K,
Na,
Ca,
Вa
и др.), расположены в главных подгруппах
I
и II
группе периодической системы. К
растворенным в воде основаниям относится
и гидроксид аммония
-
гидроксид кальция. Металлы, образующие
в воде гидроксиды (K,
Na,
Ca,
Вa
и др.), расположены в главных подгруппах
I
и II
группе периодической системы. К
растворенным в воде основаниям относится
и гидроксид аммония
 ,
но щелочью он не является. Если металл,
образующий основание, может проявлять
переменную валентность, то при
названии гидроксида в скобках указывается
валентность:
,
но щелочью он не является. Если металл,
образующий основание, может проявлять
переменную валентность, то при
названии гидроксида в скобках указывается
валентность: -
гидроксид железа (II),
-
гидроксид железа (II),
 -
гидроксид железа (III).
-
гидроксид железа (III).
Главным свойством оснований является их способность взаимодействовать с кислотами с образованием соли и воды:
Амфотерные оксиды.
Это вещества, которые взаимодействуют как с кислотами, так и щелочами, с образованием соли.

В водном растворе щелочей амфотерные гидроксиды чаще всего образуют комплексные соли:
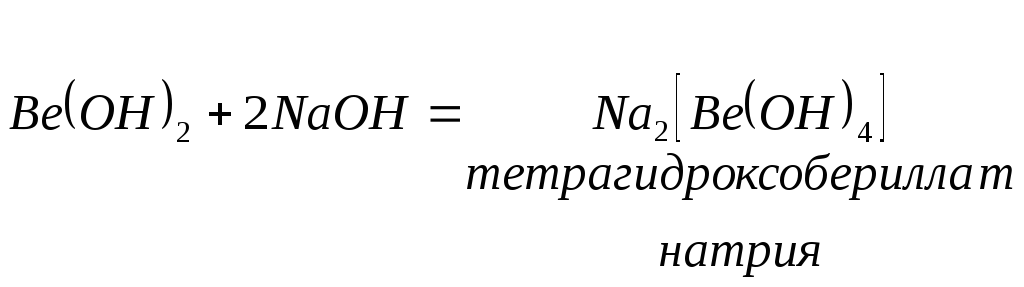
Кислоты - вещества, состоящие из атомов водорода, способных замещаться на металл, или вещества которые образуют в водном растворе из положительных ионов только ионы водорода (гидроксония):
 ;
;

По
числу атомов водорода, способных
замещаться на металл, различают
кислоты: одноосновные ( - соляная кислота,
- соляная кислота, - азотная кислота,
- азотная кислота, - синильная кислота,
- синильная кислота, - уксусная кислота и др.), двухосновные
(
- уксусная кислота и др.), двухосновные
( -
серная кислота,
-
серная кислота, - сероводородная кислота), трехосновные
(
- сероводородная кислота), трехосновные
( - фосфорная кислота,
- фосфорная кислота, - борная кислота).
- борная кислота).
По
химическому составу кислоты делятся
на кислородные
 ,
, ,
, и т.д. и бескислородные
и т.д. и бескислородные ,
, ,
, ,
, .
.
Главным химическим свойством кислот является их способность к взаимодействию с основаниями с образованием соли и воды:
Различают 5 типов солей: средние или нормальные, кислые, основные, двойные и комплексные.
Средние
или нормальные соли - продукт полного
замещения водорода кислоты на металл:
 - сульфат натрия,
- сульфат натрия, - карбонат кальция.
- карбонат кальция.
Кислые соли - продукт неполного замещения водорода кислоты на металл. Кислые соли дают только многоосновные кислоты при недостаточном количестве основания:
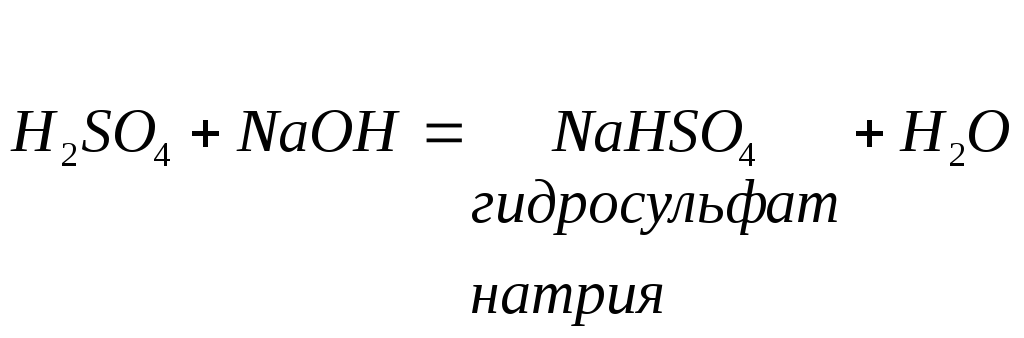

При добавлении избытка щелочи кислая соль может быть переведена в среднюю соль:
Основные соли - продукт неполного замещения гидроксид - ионов в основании на кислотный остаток. Они могут быть образованы только много кислотными основаниями (основания, содержащие несколько гидроксильных групп)
Перевести основную соль в среднюю можно, действуя на нее кислотой.

Двойные соли образуются при замещении кислорода многоосновной кислоты двумя различными катионами:
Двойные соли, как правило, существуют только в кристаллическом состоянии.
Комплексные
соли - такие вещества, в состав которых
входит комплексный ион. Примерами
комплексных солей могут быть продукты
растворения амфотерных гидроксидов в
щелочах:
 -
тетрагидроксоалюминат натрия,
-
тетрагидроксоалюминат натрия, -
тетрагидроксоцинкат натрия.
-
тетрагидроксоцинкат натрия.
Номенклатура солей и кислот.
Для наименования солей пользуются русской и международной номенклатурой.
Русское
название соли составляется из названия
кислоты и названия металла:
 -
углекислый кальций. Для кислых солей
вводится добавка "кислый":
-
углекислый кальций. Для кислых солей
вводится добавка "кислый": - кислый углекислый кальций. Для названия
основных солей добавка "основная":
- кислый углекислый кальций. Для названия
основных солей добавка "основная": - основная сернокислая медь.
- основная сернокислая медь.
Наибольшее
распространение получила международная
номенклатура. Названия солей по этой
номенклатуре состоят из названия атома
и названия катионов:
 - нитрат калия. Если металл имеет разную
валентность, то ее указывают в
скобках:
- нитрат калия. Если металл имеет разную
валентность, то ее указывают в
скобках: - сульфат железа (II),
- сульфат железа (II), - сульфат железа (III).
- сульфат железа (III).
Для
солей кислородосодержащих кислот в
название вводят суффикс "ат", если
кислотообразующий элемент проявляет
высшую валентность:
 -нитрат калия; суффикс "ит", если
кислотообразующий элемент проявляет
низшую валентности
-нитрат калия; суффикс "ит", если
кислотообразующий элемент проявляет
низшую валентности - нитрит калия. В тех случаях, когда
кристалообразующий элемент образует
кислоты более чем в двух валентных
состояниях, применяют суффикс "ат".
При этом, если он проявляет высшую
валентность, добавляют префикс "пер":
- нитрит калия. В тех случаях, когда
кристалообразующий элемент образует
кислоты более чем в двух валентных
состояниях, применяют суффикс "ат".
При этом, если он проявляет высшую
валентность, добавляют префикс "пер": -
перхлорат калия, если низшую - то применяют
суффикс "ид" и префикс "гипо":
-
перхлорат калия, если низшую - то применяют
суффикс "ид" и префикс "гипо": -
гипохлорит калия. Для солей, образованных
кислотами, содержащими разное количество
воды, добавляются префиксы "мета"
и "орто". Например:
-
гипохлорит калия. Для солей, образованных
кислотами, содержащими разное количество
воды, добавляются префиксы "мета"
и "орто". Например: -
метафосфат натрия (соль метафосфорной
кислоты),
-
метафосфат натрия (соль метафосфорной
кислоты), - ортофосфат натрия (соль ортофосфорной
кислоты).
- ортофосфат натрия (соль ортофосфорной
кислоты).
В
название кислой соли вводят приставку
"гидро":
 - гидрофосфат натрия (если в молекуле
один атом водорода) и приставку "гидро"
с греческими числительными (если
атомов водорода больше одного):
- гидрофосфат натрия (если в молекуле
один атом водорода) и приставку "гидро"
с греческими числительными (если
атомов водорода больше одного): - дигидрофосфат натрия. В названия
основных солей вводится приставка
"гидроксо". Например,
- дигидрофосфат натрия. В названия
основных солей вводится приставка
"гидроксо". Например, - хлорид гидроксожелеэа (II).
- хлорид гидроксожелеэа (II).
Формулы кислот и названия их атомов.
|
Название аниона |
|||
|
Международное | |||
|
|
фтористый |
||
|
|
хлористый |
||
|
|
бромистый |
||
|
|
йодистый |
||
|
|
сернистый |
||
|
|
гидросульфид |
кислый сернистый |
|
|
|
азотистокислый |
||
|
|
азотокислый |
||
|
|
уксуснокислый |
||
|
|
перманганат |
марганцовокислый |
|
|
|
сернокислый |
||
|
|
гидросульфат |
кислый сернокислый |
|
|
|
карбонат |
углекислый |
|
|
|
гидрокарбонат |
кислый углекислый |
|
|
|
сернокислый |
||
|
|
гидросульфит |
кислый сернокислый |
|
|
|
метасиликат |
метокремневокислый |
|
|
|
ортосиликат |
ортокремневокислый |
|
|
|
фосфорнокислый |
||
|
|
гидрофосфат |
кислый фосфорнокислый однозамещенный |
|
|
|
дигидрофосфат |
кислый фосфорнокислый двузамещенный |
|
|
|
гипохлорит |
хлорноватокислый |
|
|
|
хлористокислый |
||
|
|
хлорноватокислый |
||
|
|
хромовокислый |
||
|
|
дихромат |
двухромовокислый |
|
|
|
дифосфат |
двуфосфорнокислый |
|
|
|
перхлорат |
Хлорнокислый |
|
Экспериментальная часть .
ОПЫТ 1. Получение оксидов и испытание их характеристик.
Оксид и гидроксид магния.
Поместите в пробирку небольшое количество оксида магния и прибавьте туда же 5-10 мл воды. Взболтайте содержимое пробирки и испытайте реакцию среды 1-2 каплями раствора фенолфталеина. Отметьте реакцию среды. Составьте уравнение реакции и сделайте вывод о характере оксид;
1.2.
Оксид кальция
 .
.
Небольшой кусочек мела взять железными щипцами и прокалить над пламенем горелки в течение 3-5 минут. Охлажденный прокаленный кусочек поместить в фарфоровую чашку и залить небольшим количеством воды. Испытать индикатором (фенолфталеином), отметить окраску и сделать вывод о характере среды. Написать уравнение реакции.
ОПЫТ 2. Получение кислот.
2.1
Угольная кислота
 .
.
Из аппарата Киппа пропустить углекислый газ в пробирку с водой в течение нескольких минут. Испытать раствор индикатором (метилоранжем или лакмусом). Написать уравнение реакции.
ОПЫТ 3. Получение оснований.
3.1
Гидроокись кальция
 .
.
К оксиду кальция прилить немного капель воды, размешать, испытать
индикатором. Записать реакцию среды и составить уравнение реакции.
3.2
Гидроокись алюминия
 .
.
В
пробирку налейте 2-3 мл раствора соли
алюминия и прибавьте примерно такой
же объем раствора
 .
Содержимое пробирки распределите в
две пробирки. В одну из пробирок при
взбалтывании прилейте по каплям 10%
раствор соляной кислоты до полного
растворения осадка. Во вторую пробирку
прилейте 10% раствор гидроокиси натрия
также до полного растворения осадка.
Составьте уравнения реакций. Сделайте
вывод о характере гидроксида алюминия.
.
Содержимое пробирки распределите в
две пробирки. В одну из пробирок при
взбалтывании прилейте по каплям 10%
раствор соляной кислоты до полного
растворения осадка. Во вторую пробирку
прилейте 10% раствор гидроокиси натрия
также до полного растворения осадка.
Составьте уравнения реакций. Сделайте
вывод о характере гидроксида алюминия.
ОПЫТ 4. Получение солей.
4.1. Взаимодействие кислот с основными оксидами.
В три конические пробирки внести по несколько кристаллов оксида меди и оксида магния. Прибавить по 5-6 капель соляной или серной кислоты. В случае необходимости применить нагревание. Отметить цвета получившихся растворов и написать уравнения реакций.
4.2 Взаимодействие металла с солью другого металла в две пробирки внести по 12-15 капель раствора сульфата меди и нитрата свинца. В первую положить немного металлического железа, во вторую - цинка. Наблюдать происходящие реакции, составить уравнения. Сделать вывод, в каких случаях происходит постепенное вытеснение металлов из их солей.
4.3. Получение основной соли.
К раствору сульфата меди по каплям прибавлять раствор гидроксида натрия до образования осадка. Содержимое пробирки нагреть и наблюдать изменение цвета осадка. Составить уравнение реакции.
4.4 Получение кислой соли.
Наполнить
пробирку на 1/2 ее объема известковой
водой (раствор )
и пропустить через нее диоксид углерода
из аппарата Киппа (под тягой). Отметить
появление осадка карбоната кальция.
Продолжать пропускать диоксид углерода
до растворения осадка, которое, происходит
вследствие образования кислой соли
)
и пропустить через нее диоксид углерода
из аппарата Киппа (под тягой). Отметить
появление осадка карбоната кальция.
Продолжать пропускать диоксид углерода
до растворения осадка, которое, происходит
вследствие образования кислой соли .
Составить уравнения реакций.
.
Составить уравнения реакций.
Получение нормальной соли из кислой.
К полученному в опыте 4.4. раствору кислого карбоната кальция прилить несколько капель известковой воды. Наблюдать образование осадка. Составить уравнение реакции.
Контрольные вопросы и задачи:

«Получение серной кислоты» - Кислота - окислитель. Получение из пирита. III стадия – получение H2SO4. 3-я стадия. Выводы. H2 SO2, S, H2S. 2-я стадия. Химические свойства и получение серной кислоты в промышленности. С металлами (стоящие в ряду напряжения до водорода) Zn + H2SO4 -> ZnSO4 + H2. II стадия – получение SO3. H2SO4 конц Продукт окисления.
«Кислоты взаимодействие» - Взаимодействие с основаниями. H2O. Взаимодействие с индикаторами. Аскорбиновая(витамин С) - в черной смородине, малине, лимонах, апельсинах, томатах. Немного загадок) нажмите! Na3PO4 +. Классификация кислот. Яблочная- в яблоках. CO2. МеxOy + HnКост? МеnКостy + H2O Основный оксид + кислота? соль + вода.
«Кислотные остатки» - Бескислородные кислоты. Классификация кислот. Кислотный остаток. Кислоты. Трёхосновные кислоты. Какие кислоты вы знаете? Определение степеней окисления кислотных остатков. Степень окисления кислотного остатка равна числу атомов водорода. Что объединяет все кислоты? Водород. Кислородосодержащие кислоты.
«Серная кислота» - Относительно смешивания серной кислоты с водой с давних пор существует строгое правило. Разбавленная серная кислота проявляет все характерные свойства кислот. Состав. Одноосновные кислоты. Свойства серной кислоты. Многоосновные кислоты. Применение серной кислоты. S+6O3 - бесцветная жидкость. Реактивом на серную кислоту и ее соли является катион бария.
«Производство серной кислоты» - Керамические трубки - увеличение площади соприкосновения. Полный процесс производства H2SO4. Теплообменник и контактный аппарат. В контактном аппарате полки с катализатором V2O5. Профессии работников сернокислотного производства. Принципы производства. Серная кислота сверху, оксид серы (VI) снизу. Поглотительная башня.
«Азотная кислота» - Производство красителей. 2H+ + 2NO3– + 2Na+ + SiO32– = ?H2SiO3 + 2Na+ + 2NO3–. Азотная кислота. Каким способом можно определить нитрат-ион в растворе? Азотная кислота как сильный окислитель. NaNO3 + H2SO4 = NaHSO4 + HNO3. Восстановитель. 2H+ + CO22– = ?CO2 + H2O. Валентность азота. Производство азотных и комплексных удобрений.